

1.浮游幼虫的布置时间 孵化池内幼体的密度一般较大。未能孵化的卵子和残余的精子分解后,往往对水质造成一定程度的污染,水环境一般较差,这对幼体的生长发育不利。因此,应该按照浮游幼体的培育要求,及时进行布池。布池在原肠胚就可以进行,最迟也应该在小耳状幼体消化道打通前完成。
2.布池前的处理 布池前应对孵化池中的幼体计数,计数方法基本同受精卵的计数。
孵化池的池底,往往有死亡的胚胎、幼体和发育不良活力很差的幼体,有时还可能有亲参产卵时留下的粪便和残饵。因此,在计数之前,要对池底进行吸底处理。
在气温高于水温和静水条件下,浮游幼体多集中分布于水体的上层甚表层。气温越高,这种现象越明显。在吸底前,首先要满足上述两个条件,以便使幼虫浮游于水体的表层。如果是常温育苗,吸底选择在下午2:00〜3:00就可以了,有时在晚上,气温也能高于水温。如果是人工升温育苗,则需要人为地提高气温。吸底前停止充气,待幼虫充分浮起后,即可实施吸底操作。
吸底采用虹吸法。池底一般很少有健康的幼虫,但是在吸底操作过程中,有时也会带人少量上层的健康幼虫。因此,用250目的网箱在虹吸管的出水口收集。将网箱内收集的幼虫移人水盆中,健康的幼虫则浮游于水的表层,可予以收集。如果幼虫的数量充足,从池底虹吸出的幼虫数量又很少,也可不予收集。吸底后应立即恢复充气。
3.浮游幼虫的布置方法
(1)虹吸法 如果孵化池内精液本来就很少,水质良好,可以用虹吸法直接把孵化池内的幼体分人周边的池子。分人的幼体数量以流人的水体体积计算。该法操作简单,而且幼体不宜受损伤。但是,如果培育池距离孵化池很远,甚不在一个车间,此法就不适用。
(2)浓缩法 该法是用虹吸管把幼体吸人网箱内浓缩后,移人幼虫培育池,其操作基本同受精卵的浓缩分池。
育苗池的水体是幼虫生活的直接空间,耳状幼虫在水体中的分布状态,直接关系到其对水体空间的利用。因此,这是个必须首先搞清楚的问题。
在20世纪70年代末,笔者曾对耳状幼虫的立体分布状态进行了大量的观测和实验。那时鼓风机尚未在刺参育苗中使用,也未使用其他充气设备,属于静水常温育苗,观测和实验是在这样的背景下进行的。
观察先是在7000毫升的玻璃缸内进行的。观察发现,刚布置不久的小耳状幼虫多集中于水体最表层,其他水层很少发现幼虫存在。第二天下午发现玻璃缸水面上有一片片好像灰尘状的漂浮物。取样镜检,发现该漂浮物竟是耳状幼虫。这些耳状幼虫多数活力较差,十几个、几十个甚更多个互相粘连在一起,我们把这种现象称为幼虫的“结团”现象。继续观察发现,在靠近缸壁的最表层水体中“结团”现象尤其严重,有的甚连接成长条状。下午发现幼虫“结团”现象后,晚上幼虫就开始下沉,下沉的幼虫一般难以发育下去。
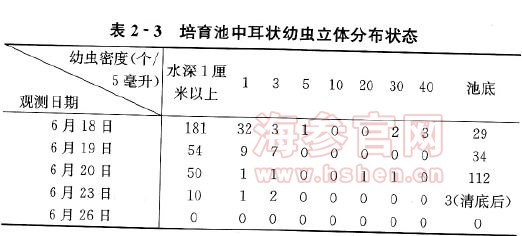
为了搞清从小耳状幼虫到大耳状幼虫的立体分布状况,笔者还对多个水池内培养的幼虫进行了大量观察。结果表明,与玻璃缸中的幼虫一样,仍多集中于最表层。随着培育时间的延续,表层幼虫逐渐减少,下沉于池底的幼虫逐渐增多。但无论数量怎样变动,除了沉于池底的幼虫之外,多数仍集中于最表层(表2-3)。水体最表层幼虫密度过大,造成幼虫互相粘连“结团”,是其下沉死亡的主要原因。参与“结团”的个体中,除了活力很差、发育迟缓的幼虫外,还有一些死亡的个体。与在玻璃缸中发现的一样,在靠近池壁的最表层水体,“结团”现象特别严重。其实,幼虫的“结团”现象在原肠胚就可以出现,并且可以一直持续到大耳状幼虫和樽形幼虫,只是因为到大耳状幼虫期,其存活数量已经很小,致“结团”现象不太明显,但大耳状幼虫仍多集中于最表层。
 耳状幼虫
耳状幼虫
观察还发现,在耳状幼虫的培育过程中,有时可以看到表层以下的各层水体中也分布有一定数量的幼虫,这是幼虫在最表层“结团”以后下沉于池底的中间过程,其中少数可能会恢复活力,继续发育,但大部分幼虫将沉于池底死亡。稚参出苗量仅与表层大耳状幼虫数量有关。
根据这一观测结果,当时认为,即使假定耳状幼虫集中于表层3厘米之内的水体,按培育池水深80厘米计算,当时的育苗方法在浮游幼虫培育阶段对水体的直接利用率尚不足4%。从充分利用水体空间的意义上讲,刺参的育苗潜力将是很大的。
根据这一思想,我们采取了用人为的方法打破幼虫的自然分布状态,使其在水体中均匀分布的技术措施,效果非常明显。由于比较充分地利用了水体,幼虫生长快、发育好,大耳状幼虫存活率高,变态整齐。初次实验四个池子,稚参平均出苗量达到13.37万头/米^2,达到18.02万头/米^2,这在当时已经算是比较高了。
用人工方法搅动水体基本可以使浮游幼虫相对均匀分布。因水体的深度和浮游幼虫的发育期不同,自行恢复自然分布状态的时间长短有所差异。一般来说,水深80厘米的育苗池,每隔半小时搅动一次水体,基本上可以达到相对均匀分布的目的。后来鼓风机在人工育苗中得到了广泛使用,人工搅动被连续充气取代。充气虽然还有增加溶解氧的作用,但其主要作用还是搅动水体,使幼虫均匀分布。人工搅动是断续的,而充气搅动则是连续的。一般说来,充气搅动优于人工动。但充气量不宜太大,充气童太大,耳状幼虫胃内容易进入气泡。充气量的大小,以距气石最远的池水能够轻微活动,幼虫能散开为宜。
高气温是造成浮游幼虫分布于最表层的主要原因。刺参常温育苗,一般是气温高于水温,有时甚高于水温很多。气温高于水温越多,浮游幼虫分布于最表层越明显。在自然海区,刺参繁殖季节虽然也是气温高于水温,但由于海水处于不停地运动中,浮游幼虫不会分布于最表层。刺参的升温育苗,如果不人为地提高气温,则气温一般低于水温,甚低于水温很多。在这种情况下,浮游幼虫多分布于水体的中下层,而且气温低于水温越多,此种现象越明显。浮游幼虫分布于水体的中下层,造成局部密度大,其危害虽然没有浮游幼虫分布于最表层那样大,但对幼虫的生长、发育也是不利的。因此,人工升温育苗必须人为地提高气温,使气温少高于水温2〜3°C。认识浮游幼虫的立体分布状态,用人为的方法使其相对均匀分布,是浮游幼虫培育阶段的关键。如果这一问题不解决,其他技术措施如换水、投饵等就不能发挥其应有的作用,稚参的出苗量不可能高。
耳状幼虫培育密度的大小,是与育苗池生态环境的优劣相联系的。如果育苗池的生态环境好,耳状幼虫的培育密度则可以大;如果育苗池的生态环境差,耳状幼虫的培育密度则不能大;如果育苗池的生态环境差到幼虫难以适应的程度,则不管密度大还是小,幼虫都难以生存。生态环境是水质、水温、饵料等各个因子的综合。育苗池的生态环境是人工制造的,并且受人的监控。有的人能制造出好的生态环境,并且能通过人工调控保持下来;有的人则未能制造出好的生态境;有的人自以为制造出了好的生态环境,实际上却并不是个好的生态环境。20世纪70年代末到80年代初,曾做过不少耳状幼虫培育密度对比实验。起初倾向于0.8〜1个/毫升的培育密度,后来又倾向于0.3〜0.5个/毫升的培育密度,但这大都是在静水培育条件下得出的结论。采用人工搅动的措施使幼虫均匀分布,扩大了幼虫对水体空间的利用,改善了幼虫的生态环境。再配合施加素和三角褐指藻4万细胞/毫升的投饵量,我们把耳状幼虫的培育密度增加到2个/毫升,结果在7000毫升的玻璃缸中取得很好的效果。稚参平均出苗量为82.9万头/米^3,平均成活率为41.4%,稚参出苗量为128.6万头/米^3,成活率为64.32%。当然,这是小水体的实验结果,但起码可以说明,2个/毫升的培育密度不是不可行的。
需要说明的是,在相同的生态环境中,若耳状幼虫的培育密度较小,则生长较快,变态前的大耳状幼虫个体大,稚参更健壮。另外,提高耳状幼虫的培育密度,虽然可以相应地提高稚参的出苗量,但稚参的密度太高,反而不利于继续养。也就是说,稚参的密度太高,在目前似乎必要性不大。现在耳状幼虫的培育密度多在0.3〜05个/毫升,这一培育密度与变态后稚参的培养密度比较适应。但从提高稚参出苗量来看,这并不是最适宜的培养密度。如果需要提高稚参的出苗量,耳状幼虫的培养密度还可以提高,起妈将耳状幼虫的培育密度提高到1个/毫升是可以的。
1.换水 换水是改善水质的最快捷、最方便的手段,是浮游幼虫培育阶段的主要工作之一。在小耳状幼虫布池后的第,由于水质清新,可以不换水而采用加水的方式,从第二天开始再换水。
换水的工具主要有滤鼓和网箱两种。二者比较,滤鼓的过滤面积小,幼虫容易被吸附于过滤网上,造成损伤,而且摇晃滤鼓的劳动强度也大,不宜采用。网箱的过滤面积则大得灸,而且操作方便,劳动强度低,是比较好的换水工具。过滤网的网目在幼虫不流失的前提下,越大越好。这样,水体中的有机颗粒容易随水流出。过滤网可用200目的筛絹。每次换水前都应检查网箱,査看是否有漏洞。
换水每天2次。小耳状幼虫期,每次换水1/4;中耳状幼虫期,每天换水1/3,进入大耳状幼虫期之后,每次换水1/2。
2.吸底 在浮游幼虫培养过程中,残饵、幼虫的粪便、幼虫的尸体以及畸形滞育的幼虫,沉积于池底,使得的数量增加,原生动物迅速繁殖,生态环境较差。换水对改善水体的质量效果较明显,但对改善池底的环境却作用不大,这需要通过吸底解决。吸底一般共两次,一次在中耳状幼虫后期,一次在投放附着基之前。吸底的方法前已述及,这里需要强调的是,随水流出的幼虫需收集,其中健康的幼虫要收回。
3.倒池 倒池是将幼虫通过网箱浓缩后,移人经处理的池子的操作,是改善水体环境和池底环境最有效的方法。其缺点是容易对幼虫造成损伤,一般不予采用。如果幼虫死亡率较高,池底环境很差,可在投附着基之前倒池—次。
常温育苗,一般不需要控制水温。但是使用池塘养殖的亲参育苗,在浮游幼虫培育阶段,如果自然水温较低,有条件的单位把水温提高到最适温度。人工升温育苗,在浮游幼虫培育阶段,则必须提高水温。
培育水温可在18〜20°C之间选择。培育水温确定之后,可以小幅度上升,不要下降。如果水温下降,换水时可以加高于池水温度1〜2°C的高温水提温。
育苗室内的气温应高于水温2〜3°C。其作用一是防止水温下降,二是不致使浮游幼虫往中下层分布。
1.适宜的单细胞藻 饵料种类刺参耳状幼虫对有纤维素细胞壁的浮游单细胞藻类不能消化。
盐藻只有细胞膜而无细胞壁,易于消化。其营养价值较高,含有18种氨基酸,特别是其J3-胡萝卜素含量很高,是耳状幼虫的适宜馆料。
角毛藻、三角褐指藻和小新月菱形藻具有果胶质的细胞壁,容易消化,角毛藻含有18种氨基酸,氨基酸总量占21%以上(对干藻重)。三角褐指藻亦含有18种氨基酸,氨基酸总量占28%以上,也是耳状幼虫的适宜饵料。
等鞭藻(金藻)无细胞壁,蛋白质含量为40%〜60%,等鞭藻3011氨基酸含量33%以上。
扁藻、小球藻、异胶藻具有纤维素的细胞壁,耳状幼虫难以消化,不宜作为馆料。耳状幼虫摄食扁藻并无困难,但却难以消化,甚从其肠道排出的扁藻仍可活动,长时间投喂扁藻,耳状幼虫的胃容易萎缩。
多年的育苗试验和生产实践的结果表明,盐藻、角毛藻、三角褐指藻、小新月菱形藻,无论是单独投喂,还是混合投喂都可以取得很好的育苗效果。从理论上讲,两种或两种以上的单细胞藻混合投喂,营养更全面。但是,实践证明,上述四种单细胞藻单独投喂同样可以取得很好的育苗效果。这说明,单独投喂已能满足幼虫的营养需要,所以,不要一味地追求混合投喂,要根据本单位单细胞藻饵料的培养状况,因时因地制宜。
三角褐指藻和小新月菱形藻的适宜生长温度为10〜20°C,最适温度为14〜18°C,在水温低于20°C时,应大量培养这两种单细胞藻,以确保饵料供给。如果有升温设备,可以同时培养部分盐藻和角毛藻;如果没有升温设备,则不必一定要培养盐藻和角毛藻。即使培养,占的比例也不应大,以免影响三角褐指藻和小新月菱形藻的生产数量。
当水温超过20°C,特别是超过23°C时,三角褐指藻和小新月菱形藻已不好培养。这时不能再以这两种单细胞藻为主要饵料。盐藻、角毛藻和几种等鞭藻(金藻)对高水温的适应能力都比较强,最适水温为25〜30°C。应大量培养角毛藻。盐藻繁殖速度较慢,而且容易污染,难以满足供应,—般不宜作为主要饵料。等鞭藻比盐藻容易培养,但据报道,单独投喂等鞭藻,幼体在变态前易于发生胃溃烂现象,采用混合投喂(隋锡林,1990)。
2.对单胞藻 饵料质量的要求在目前开放式培养的条件下,单细胞藻的质量变化快、起伏大,是育苗生产中最不稳定的因素之一,对育苗生产影响较大。因此,必须把握好单细胞藻饵料的质量。
质量好的单细胞藻藻液具有该种特有的鲜亮色泽,镜检无原生动物,无老化细胞。
原生动物污染和藻细胞老化是判别单细胞藻饵料质量的两个主要指标。
即使是开放式培养的单细胞藻,也可以作到基本无原生动物污染,但是大多数生产厂家目前还做不到。在显微镜下检查,如果偶尔发现原生动物,可以放心投喂;如果一个视野(10X10)发现2〜3个原生动物也可以投喂;如果一个视野发现多个(3个以上)原生动物,则不投喂。在发现原生动物存在,特别是一个视野(10X10)发现2〜3个原生动物时,要勤于镜检,观察原生动物的增殖趋势。一般来说,如果天气晴朗,光照充足,原生动物的增殖有可能被抑制;如果阴天下 雨,光照不足,原生动物往往会大量增殖。
单细胞藻老化的主要表现是,镜检轻则几个细胞互相粘连,并伴有部分细胞分解而呈絮状,从外观看,藻液浑浊灰暗。充气时有大量白色泡沫甚黄色泡沫出现,池壁有黄色絮状物附着。池底有大量藻体及其分解物沉积。老化的根本原因是其生态环境恶化。老化的单细胞藻往往伴随着原生动物污染。
以现在的培养技术,要做到单细胞藻不出现老化现象是完全可能的。老化的单细胞藻对于耳状幼体的影响是非常严重的,原则上不能投喂。如果确实无质量好的单细胞藻饵料投喂,在显微镜下,偶尔看到几个细胞粘连的轻微老化的单细胞藻,可以考虑投喂。但是,严重老化的单细胞藻决不能投喂。
在正常情况下,三角褐指藻、小新月菱形藻的密度培养到200〜300万细胞/毫升,角毛藻、等鞭藻的密度培养到200万细胞/毫升左右,盐藻的密度培养到100万细胞/毫升左右,并不难办到。如果单细胞藻饵料供应紧张,细胞密度达不到上述密度,只要质量合乎要求也可以投喂,但是细胞密度过低是对单细胞藻生产能力的一种浪费。
每次投喂之前都要对饵料的质量进行检査,并计数。
3.单细胞藻 饵料的投喂量投喂量与耳状幼虫分布状态、换水量、幼虫培育密度等因素有关。幼虫在水体中分布相对均匀,可以充分利用饵料;如果幼虫多分布于水体上层乃最表层或者分布于中下层,饵料则不能被充分利用,每次投饵后到下次投饵前,饵料总会有些剩余。换水可以排出部分剩余馆料,换水量越大,排出的剩余饵料量越大。幼虫密度大,消耗饵料则多。在本书给出的耳状幼虫培育密度0.3〜0.5个/毫升和其他培育条件下,日投饵量,小耳状幼虫为2〜3万细胞/毫升;中耳状幼虫为3〜3.5万细胞/毫升;大耳状幼虫为3.5〜4万细胞/毫升,分四次投喂,每次换水后1次,每两次换水间1次。这里所说的“X万细胞/毫升”指的是投人育苗池内的单细胞藻饵料,在不考虑幼虫摄食的数量和残饵的数量的条件下,在该育苗池内造成的饵料细胞密度。
在幼虫消化道打通时,就应该开始投饵,少量饵料可以刺激小耳状幼虫胃充分膨胀。
投饵前和投饵后应对幼虫进行镜检。根据其摄食情况适当调整投饵量。投饵后半小时镜检,如果绝大部分幼虫胃内饵料颜色明显,并且饵料颗粒多;投饵前,大部分幼虫胃内尚有饵料颜色,并可见到饵料颗粒,则说明投饵量适宜。投饵后半小时虽然幼虫胃内饵料尚充分,但下次投饵前,部分幼虫空胃,则说明饵料欠缺,应加大投饵量。如果投饵前,幼虫胃内饵料仍很多,肠道内充满粪便,则说明投饵量过大。只要计数准确,上述投饵量一般不会出现饵料过多或严重不足的现象。
4.其他饵料 除了单细胞藻饵料之外,还有一些可以作为刺参耳状幼虫的饵料。主要有:海洋酵母、面包酵母、螺旋藻粉和鼠尾藻磨碎液、鼠尾藻粉。但除了海洋酵母外,其他投喂效果均不佳。20世纪70年代末,山东省海水养殖研究所与中国科学院海洋研究所合作,曾进行了海洋酵母培养与饲育刺参耳状幼虫的试验。通过对7种海洋酵母:海洋酵母304、海洋酵母11、海洋酵母606、海洋酵母409、海洋酵母216、海洋酵母125、海洋酵母112以及三角褐指藻、扁藻、扁藻与三角褐指藻混合共10种饵料投喂效果的小型对比试验,筛选出了投喂的海洋酵母11。它与三角褐指藻的饵料效果相当,甚还略好于三角褐指藻。其他6种海洋酵母的投喂效果均很差,仅仅略好于扁藻。海洋酵母11与三角褐指藻在育苗池的投喂对比试验表明,海洋酵母11的饵料效果与小试验的结果基本相当,但略低于三角褐指藻。这表明,并不是所有的海洋酵母都适宜作为刺参耳状幼虫的饵料。可以认为,海洋酵母11是耳状幼虫的比较适宜的饵料,它的饵料效果与三角褐指藻相当。
这里需要指出的是,我们使用的海洋酵母都是活细胞,未经冷藏保存,不存在冷藏运输变质的问题。观察发现,海洋酵母11悬浮性及浮游性强,分布均匀,不下沉,投喂24小时后尚能保持悬浮状态。海洋酵母的细胞壁为多聚糖、蛋白质和几丁质,没有纤维素。镜检发现,海洋酵母在耳状幼虫胃内分布较均匀,并随胃的蠕动而不停地运动,在胃肠交界处粘结成团,部分细胞的形状不易分辨,可见消化较好。市售的海洋酵母商品密度很高,便于冷藏运输,这对弥补单细胞藻的不足,应该是很有利的。但是,有的育苗厂家反映其投喂效果不好,需要查找原因。
耳状幼虫的生长与受精卵的质量和生态环境有密切关系。受精卵内营养物质贮备丰富,则耳状幼虫生长快。生态环境的各个因子对耳状幼虫的影响是综合性的,其中水温的变化对其影响较明显。表2-4给出了耳状幼虫的生长数据。

培育池池水的理化因子是耳状幼虫生态环境的重要组成部分,对育苗生产影响甚大。虽然育苗用水水源的水质符合有关质量标准,但是,在育苗培育过程中,池水的水质是会发生变化的,有时甚会发生很大的变化。因此,应按时对池水的理化因子进行监测,并采取措施使其满足耳状幼虫生长发育的需要。这些理化因子主要有盐度、pH、溶解氧、有机物耗氧量、氨氮。
1.盐度刺参幼体 适宜的盐度为26.2〜32.7。当盐度低于21时,幼体会大量死亡。盐度突然大幅度降低,往往与降水有关。在大雨过后,要加强监测。在确定的温度下,盐度仅与比重有关,而测量比重比测量盐度更为方便,可由下述公式将比重换算成盐度:测定时水温(t)高于17.5°C时:S=1305(比重一1)+0.3(t—17.5) 测定时水温(t)低于17.5°C时:S=1305(比重一1)—0.2(17.5—t) 波梅比重计读数换算为盐度:S=144.3+(144.3—波梅度数) 现在已有市售的多功能水质测量仪器,可以直接显示盐度,测量更加简单方便。
2.pH pH不但影响幼体的新陈代谢,而且还会影响离子态氨氮(NH4+_N)与非离子态氨氮的转化。海水中的pH通常是很稳定的,一般为8.10〜8.30。在海水中生长的海洋动物及其幼体长期以来对其稳定的pH环境形成了一种适应,对pH的变化比较敏感。据报道,当海水中的pH下降到6以下或上升到9以上,幼体活力减弱,生长停止,并会发生死亡。单细胞藻饵料的pH—般较高,大量投喂单细胞藻饵料是影响池水pH的一个因素。单细胞藻的光合作用吸收二氧化碳,可以使池水中pH升髙;其呼吸作用释放出二氧化碳,可以使池水中pH降低。池水中的有机物被微生物分解和原生动物大量繁殖,也可产生二氧化碳,这些都是影响pH的因素。但是,海水酸性和碱性物质有比较强的缓冲作用,以上这些因素一般不于使池水PH发生大的变化。新建水泥池因浸泡时间过短和洗刷不彻底,由于碱性物质溶出,往往使池水的pH明显升高,甚超出耳状幼虫的适应范围,应该引起重视。
3.溶解氧 溶解氧是耳状幼虫呼吸作用的氧气来源,也是维持其正常代谢必不可少的物质。当池水的溶解氧低于3.0毫升/升时,幼虫将会大量死亡。溶解氧的安全量应在1.0毫升/升以上。刚从海上抽取的海水溶解氧通常呈饱和状态,饱和溶解氧的氧含量与水温和氯度有关。在耳状幼虫培养阶段,池水中的饱和溶解氧通常为5.32〜5.69毫升/升。
对池水中溶解氧的消耗主要有:幼虫的呼吸作用、原生动物的呼吸作用、投喂的单细胞藻的呼吸作用,好气性微生物分解有机质也是耗氧的一个因素,桡足类大量繁殖更是大量耗氧,切不可忽视。
多年的育苗实践表明,即使在搅动培养条件下,育苗池水中的溶解氧也大都在4.0毫升/升以上,未发现耳状幼虫缺氧的现象。
4.有机耗氧量 有机耗氧量是海水中有机物含量的一个指标。有机物含量高,则微生物数量多。微生物分解有机质耗氧,会产生某些有害物质。自然海区海水的有机耗氧量因海区不同而会有些差别,同一海区的不同时间也会不同。大风“发海”时,有机耗氧量也会增加。海水经过沉淀、沙滤等处理后,有机物的含量一般并不高。池水中有机质的来源主要是老化的饵料和死亡的幼体。浮游幼体培育期间,有机耗氧量不应超过2毫升/升。据多年的测定结果,幼体培育池海水中的有机耗氧量一般不超过1毫升/升(隋锡林,1990)。但若投喂酵母、藻粉等饵料,池水的有机耗氧量会明显上升。
5.氨氮 氨氮是离子态氨氮(NH4+_N)和非离子态氨氮(NH3_N)的总称。对幼体有毒害作用的是非离子态氨氮《离子态氨氮和非离子态氨氮在水中可以相互转化并最终达到某种平衡。达到平衡时它们各自所占的比例取决于水温和pH。其中pH的影响很大,水温和pH越高,非离子态氨氮占的比例越大。池水中的溶解氧能把氨氮氧化成亚硝态氮(Nor1)和硝酸态氮(N〇r2),亚硝态氮和硝酸态氮对幼体没有毒害作用。
自然海区海水中的氨氮通常很低,一般不超过120毫克/米^3。育苗池中的氨氮主要来自幼体的代谢产物、死亡幼体、粪便的分解产物。需要指出的是,培养单细胞藻时,因施加含有氨氮的肥料(硝酸铵),藻液中氨氮浓度往往较高。随单细胞藻饵料带人的氨氮也是主要来源之一,特别是单细胞藻傳料密度很低时,氨氮浓度本来就大,投喂量又多,结果随饵料进人育苗池中的氨氮量增大。山东省海水养殖研究所报道,氨氮含量超过500毫克/米^3时,则对幼体的生长发育产生不良影响。辽宁省海洋水产研究所多年的监测结果,氨氮在400毫克/米^3以内,幼体生长发育正常。耳状幼虫培育池中海水的氨氮一般均在200毫克/米^3以下,很少出现超过200毫克/米^3的时候。
耳状幼虫对生态环境的变化比较敏感。耳状幼虫的培育是刺参人工育苗中比较脆弱的时期。外部环境的不利影响,往往很快在幼虫的生长发育上反映出来。因此,对耳状幼虫的生长、发育状况要勤于观察和镜检。
观察的覆盖范围大,在短时间内可以大体掌握幼虫的一些生态状况,比较容易发现明显的异常现象,对从全局上了解幼虫的状况有一定作用。观察的主要内容有以下几项:
1.耳状幼虫的浮游和分布状况 在充气条件下,耳状幼虫分布相对均匀,为正常状态。如果上层甚中层幼虫数量明显减少,即为不正常。出现这种现象的主要原因,一般是室内气温过低,应及时提高气温。在换水时,加人新鲜海水的过程中,可以见到耳状幼虫上浮明显,上层耳状幼虫数量明显增加,为正常状态。
2.充气状况 充气量受各种因素的影响,是个容易发生变化的因素。对充气量的要求是小而均匀。经常出现的问题是气石放置不均形成充气死角,池子一端充气量大,另一端充气量小,或者部分气石充气量大,部分气石充气量小,发现这种现象应及时调整。
观察是个粗略的行为,只能了解和发现浅层次的问题,要真正掌握幼虫的生长发育状况,必须进行镜检。
镜检要抓住重点。耳状幼虫从外部获得营养,是靠胃对饵料的消化吸收完成的,这是幼虫正常生长发育的物质基础。因此,胃部的形态是否正常,胃内饵料是否充足,是镜检特别应该关注的重点。
耳状幼虫的胃呈鸡蛋形,前端圆钝,后端稍尖,中间膨大。胃壁薄而光滑规则,是正常形态。胃内饵料颗粒明显,胃液颜色与其周围颜色区别明显,饵料颗粒在胃内随胃液一起不断流动,这表明胃的功能正常。通常容易出现的问题是:胃部萎缩,胃腔变得狭窄,同时胃壁增厚,而且不再光滑、规则。
外部形态和生长发育状况也是镜检的内容。幼虫臂是耳状幼虫特有的形态特征。耳状幼虫形态是否正常,主要体现在幼虫臂上。正常的耳状幼虫左右对称,幼虫臂粗壮、挺拔。生长发育是耳状幼虫营养是否充足、代谢是否正常、活力强弱的体现。在正常情况下,耳状幼虫的体长平均日增长一般为50微米左右。耳状幼虫的发育主要看水体腔。小耳状幼虫水体腔为圆形的囊状,中耳状幼虫水体腔为长囊状,大耳状幼虫的水体腔,在长囊状基础上出现凸凹呈花生状,大耳状幼虫后期,水体腔呈指状。
生物是个有机的统一体。外部形态正常和生长、发育也是统一的,而这些都需要从外部吸收充足的营养物质来支撑。一般地说,只要幼虫的胃部形态正常,摄食充足,消化吸收好,幼虫的生长发育是不会有问题的。如果出现外部形态和生长发育不正常,往往首先表现在胃部形态不正常。
大耳状幼虫后期,同时具备四个完善的形态特征,是顺利变态为樽形幼虫的条件。这四个形态特征是:体长900微米以上;五对球状体明显;胃部膨胀;触手原基呈小指状。—般来说,这四个特征是统一体。体长不足900微米的大耳状虫,只要具备其他三个特征,也可以变态为樽形幼虫。但是樽形幼虫乃变态为稚参后,个体都较小。为了得到个体大而健壮的稚参,能把大耳状幼虫培养到体长1000微米左右,甚1000微米以上。
有的大耳状幼虫球状体似乎还算明显,但触手原基发育不充分,也未能发育成小指状。这样的大耳状幼虫变态时,虽然也可以看到其身体在收缩,但决不能变态为正常的樽形幼虫,也不会再发育下去。
一般来说,具备以上四个形态特征的大耳状幼虫顺利地变态为樽形幼虫后,以后的变态也不会存在障碍。
小谢手机和微信:13889481795(长按复制加微信)